Una strategia di vaccino a mRNA in fase di studio per combattere l’influenza, come iniezione e spray intranasale
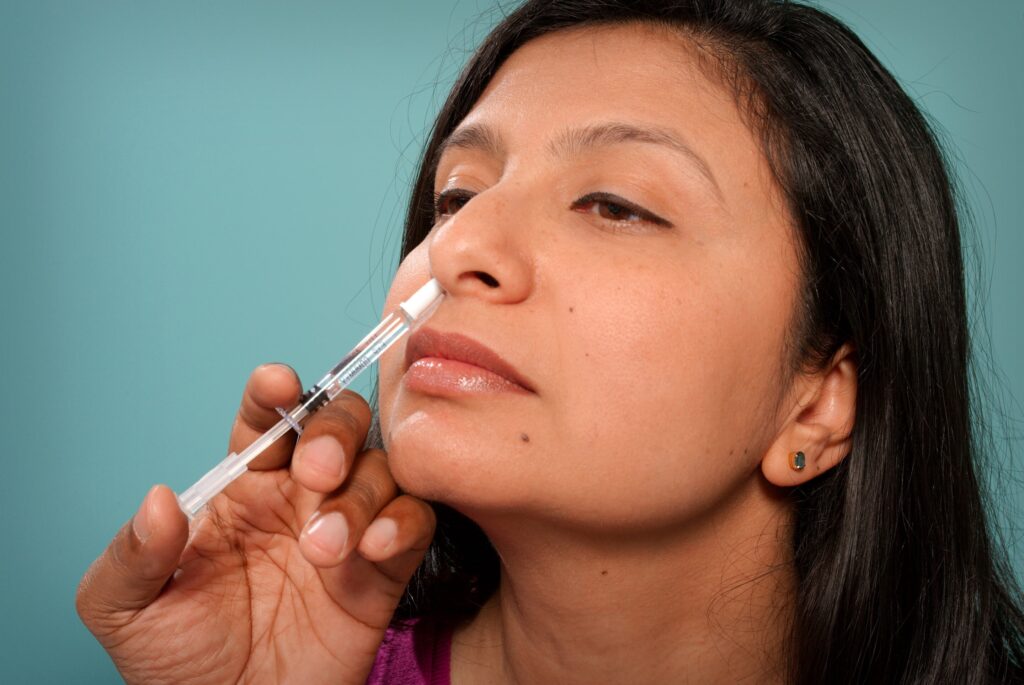
La tecnologia del vaccino a RNA messaggero, una volta un’arcana area di ricerca, è diventata terminologia familiare a causa della pandemia di COVID-19, e ora gli scienziati stanno lavorando a una strategia per il vaccino antinfluenzale a mRNA che, almeno in questo studio, prevede una prima dose somministrata come iniezione ma un booster somministrato come spray nasale mRNA.
Il vaccino è noto come vaccino a mRNA autoamplificante che prende di mira la nucleoproteina virale dell’influenza. Quella struttura nei virus dell’influenza A è una proteina multifunzionale altamente conservata ed è un obiettivo chiave nella ricerca sui vaccini e sugli antivirali perché è meno probabile che muti rispetto alle proteine di superficie virale.
La strategia ideata dai ricercatori, principalmente dell’Università del Minnesota che stanno lavorando con collaboratori altrove negli Stati Uniti, è stata quella di generare cellule T di memoria residenti nei polmoni che sono mantenute stabilmente nei tessuti respiratori.
Finora, la ricerca è in corso su modelli animali, ma la speranza è quella di creare un vaccino – e un metodo di somministrazione del vaccino – che aiuti a sconfiggere uno dei nemici più persistenti dell’umanità: l’influenza.
Ogni anno negli Stati Uniti, circa 36.000 decessi e milioni di ricoveri sono dovuti a malattie correlate all’influenza. A livello globale, l’Organizzazione mondiale della sanità stima da 250.000 a 500.000 decessi per influenza all’anno. E nel caso delle pandemie influenzali, l’infezione virale provoca danni ancora più catastrofici, come avvenne nel 1918, quando circa 500 milioni di persone, circa un terzo della popolazione mondiale, furono infettate dal virus e 50 milioni morirono.
L’obiettivo della ricerca con sede in Minnesota era una strategia vaccinale contro l’influenza a mRNA che spinge le cellule T della memoria residenti a aprirsi a ventaglio nei polmoni e ad essere preparate in caso di infezione.
“Le cellule T di memoria residenti nel tratto respiratorio, tipicamente generate da vaccinazioni o infezioni locali, possono accelerare il controllo delle infezioni polmonari che sfuggono agli anticorpi neutralizzanti”, scrive il dott. Marco Künzli del Center for Immunology presso il Dipartimento di Microbiologia e Immunologia dell’Università del Minnesota .
“Non è noto”, ha aggiunto Künzli, “se la vaccinazione mRNA stabilisca cellule T di memoria residenti respiratorie”.
In qualità di autore principale dello studio, che è stato pubblicato su Science Immunology , Künzli e un ampio team di scienziati volevano sapere se potevano fare proprio questo: aiutare a stabilire cellule T della memoria respiratoria residenti nei polmoni di modelli animali tramite la tecnologia del vaccino mRNA. .
La strategia che hanno ideato per la ricerca, che ha funzionato, ha comportato un primo e un potenziamento iniziale con la vaccinazione intramuscolare seguita da un richiamo intranasale secondario. Questa strategia ha promosso in modo efficiente le cellule T CD4 e CD8 di memoria nel tessuto polmonare. Al di là della ricerca attuale, i risultati aiutano a evidenziare come la tecnologia del vaccino a mRNA possa essere adattata per proteggere i polmoni da qualsiasi infezione respiratoria, ad esempio, come l’ RSV – virus respiratorio sinciziale – o oltre l’RSV, qualsiasi altro agente patogeno da una vasta gamma di agenti infettivi respiratori .
Mentre le vaccinazioni intramuscolari prime e boost erano sufficienti per indurre le cellule T di memoria residenti respiratorie nei modelli animali, un ulteriore boost intranasale ha ulteriormente ampliato le cellule T di memoria sia circolanti che polmonari, hanno scoperto i ricercatori.
“Abbiamo generato un vaccino mRNA auto-amplificante che codifica la nucleoproteina del virus dell’influenza A”, ha continuato Künzli, osservando che la nucleoproteina “è incapsulata in nanoparticelle modificate a base di dendron”.
“Segnaliamo come le vie di immunizzazione nei topi, compresi i potenziamenti intramuscolari controlaterali rispetto a quelli ipsilaterali, o le vie endovenose e intranasali, hanno influenzato l’immunità cellulo-mediata e umorale specifica dell’influenza”, ha affermato Künzli.
Gli scienziati non hanno lasciato nulla di intentato nella loro ricerca. Dopo la strategia di somministrazione su più fronti, hanno controllato le funzioni delle cellule T della memoria residente respiratoria nei topi attraverso la parabiosi, un protocollo chirurgico comunemente utilizzato negli studi immunologici che coinvolgono la sottopopolazione delle cellule T della memoria residente respiratoria.
L’analisi iniziale ha dimostrato che le cellule T della memoria residente respiratoria si sono insinuate nel tessuto polmonare diventando residenti a lungo termine dopo la somministrazione intramuscolare di primo impulso. Il booster intranasale, che ha ulteriormente aumentato il numero di cellule T di memoria residenti respiratorie, ha contribuito a stabilire cellule T CD4 e CD8 di memoria, circolanti e residenti nei polmoni.
La nuova ricerca, che mostra il potenziale per nuovi modi di somministrare un mRNA per raggiungere un obiettivo immunologico, arriva dopo il successo dei vaccini mRNA contro SARS-CoV-2.
Gli scienziati stanno anche portando avanti la ricerca sui vaccini a mRNA per un gran numero di diversi disturbi medici, tra cui varie forme di cancro, malattie rare e, sì, numerose malattie infettive. La nuova ricerca sull’influenza sottolinea che la tecnologia dell’mRNA non è solo robusta, ma può essere esplorata come un’arma altamente personalizzata contro l’influenza.
“Le prospettive sono entusiasmanti per combattere i patogeni emergenti, i patogeni antigenicamente variabili che potrebbero essere affrontati dalla vaccinazione megavalente e forse le condizioni di non infezione come i vaccini tumorali personalizzati”, ha osservato Künzli.
More information: Marco Künzli et al, Route of self-amplifying mRNA vaccination modulates the establishment of pulmonary resident memory CD8 and CD4 T cells, Science Immunology (2022). DOI: 10.1126/sciimmunol.add3075

