Gli scienziati scoprono come il blocco dei recettori oppioidi in neuroni specifici possa ripristinare la respirazione durante un sovradosaggio
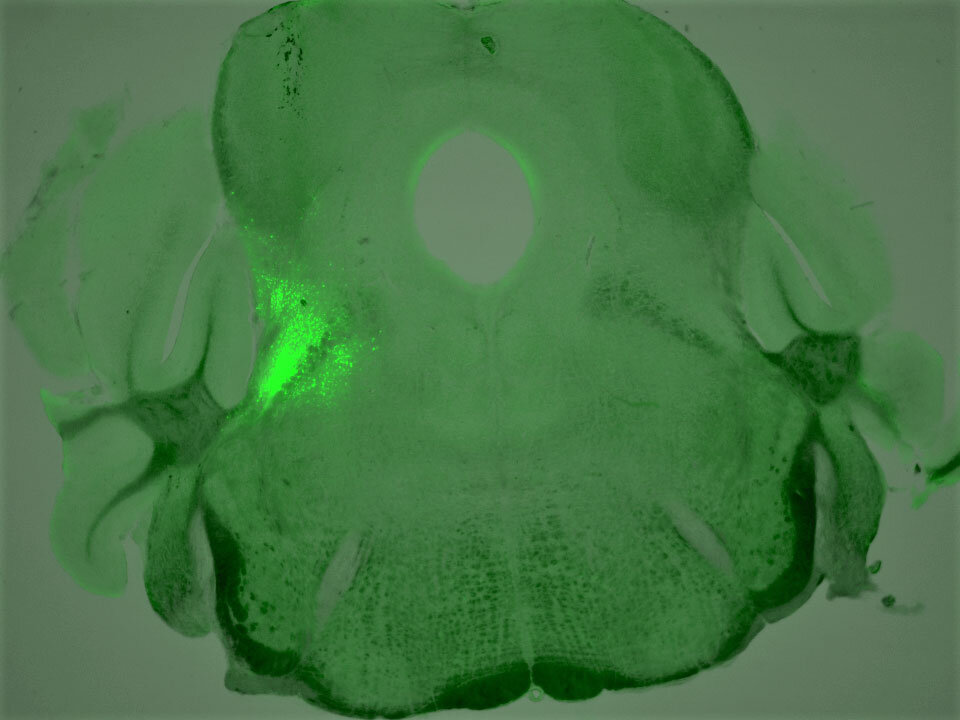
È noto da tempo che le morti per overdose da oppiacei sono causate da disturbi respiratori, ma il meccanismo reale con cui questi farmaci sopprimono la respirazione non è stato compreso. Ora, un nuovo studio degli scienziati di Salk ha identificato un gruppo di neuroni nel tronco cerebrale che svolge un ruolo chiave in questo processo.
I risultati, pubblicati l’8 giugno sulla rivista Proceedings of the National Academy of Sciences , mostrano come l’attivazione di recettori specifici in questi neuroni causi depressione respiratoria indotta da oppiacei, o OIRD, la respirazione interrotta che causa morti per overdose. Mostra anche come il blocco di questi recettori può causare l’inversione dell’OIRD.
“Il meccanismo alla base del perché gli oppiacei rallentano e deprimono il ritmo respiratorio non è stato completamente caratterizzato”, afferma il ricercatore senior Sung Han, assistente professore presso i Clayton Foundation Laboratories for Peptide Biology di Salk. “Questa conoscenza può fornire un trampolino di lancio per migliori opzioni di trattamento per l’OIRD”.
Gli Stati Uniti hanno visto oltre 93.000 morti per overdose nel 2020, di cui circa il 60% attribuito a oppiacei come il fentanil. Gli oppioidi funzionano legandosi a proteine sulle cellule nervose (neuroni) chiamate recettori oppioidi e successivamente inibendo la loro attività. Attualmente, il naloxone è l’unico farmaco noto per bloccare gli effetti degli oppioidi e invertire un’overdose. Ma il naloxone ha dei limiti, inclusa una breve durata che richiede che venga somministrato più volte. Funziona anche a livello sistemico, bloccando i recettori degli oppioidi in tutto il corpo, compresi quelli che controllano il dolore.
Per sviluppare strategie per salvare l’OIRD con maggiore specificità, il team di Han ha iniziato a cercare i neuroni respiratori nel cervello che trasportano anche i recettori degli oppioidi. Nel nuovo studio, i ricercatori hanno identificato un gruppo di neuroni che esprimono un certo tipo di recettore oppioide (il recettore oppioide mu) e si trovano nel centro di modulazione della respirazione del tronco cerebrale; hanno poi caratterizzato il ruolo di questi neuroni nell’OIRD.
Hanno scoperto che i topi che sono stati geneticamente modificati per non avere recettori per gli oppioidi in questi neuroni non hanno avuto la loro respirazione interrotta quando esposti alla morfina, come hanno fatto i topi nel gruppo di controllo . I ricercatori hanno anche scoperto che, senza introdurre oppioidi, la stimolazione di questi recettori nei topi di controllo ha causato sintomi di OIRD.
Il team ha quindi esaminato i modi per invertire il processo trattando i topi sovradosati con composti chimici mirati ad altri recettori sugli stessi neuroni, che svolgono un ruolo opposto al recettore degli oppioidi (attivandoli anziché inibirli).
“Abbiamo scoperto quattro diversi composti chimici che hanno attivato con successo questi neuroni e riportato la frequenza respiratoria durante l’OIRD”, ha detto il primo autore Shijia Liu, uno studente laureato nel laboratorio Han. Il recupero nei topi overdose era vicino al 100%, il che ha sorpreso il team.
I ricercatori hanno poi intenzione di verificare se anche altri gruppi cellulari svolgono un ruolo nell’OIRD. Ulteriori studi esaminerebbero anche la connessione tra la regolazione della respirazione e la percezione del dolore nel cervello, aprendo potenzialmente la porta allo sviluppo di trattamenti più mirati per l’OIRD.
“Speriamo di spiegare la segregazione della respirazione del dolore a livello molecolare o di microcircuiti”, afferma Han, che detiene il Pioneer Fund Development Chair. “In questo modo, possiamo provare a ripristinare la respirazione senza toccare gli effetti analgesici degli oppioidi”.
Altri autori dello studio sono Dong-Il Kim, Tae Gyu Oh, Gerald M. Pao, Jong-Hyun Kim, Kuo-Fen Lee e Ronald M. Evans di Salk; Richard Palmiter dell’Università di Washington; e Matthew R. Banghart dell’Università della California, San Diego.

