Dinamiche dietro le proteine cruciali nel cancro al seno
Guardare uno spettacolo di marionette può insegnarti qualcosa su come funzionano gli estrogeni nel corpo, secondo gli scienziati della Rice University la cui ricerca potrebbe aprire la porta a nuove strategie per regolare l’ormone, che potrebbe aiutare a prevenire il cancro al seno e altre malattie.
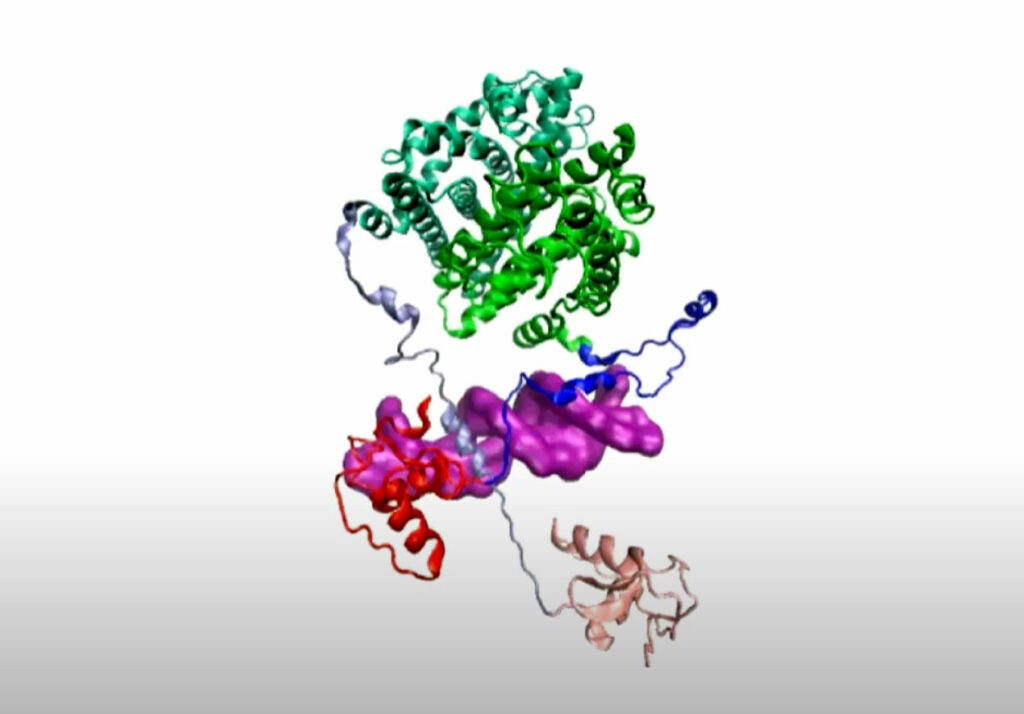
Proprio come un burattinaio manipola le stringhe, un recettore degli estrogeni , una volta che si lega a una molecola ormonale, manipola la sua struttura per accedere a un sito specifico del DNA, dove migliorerà o inibirà l’espressione genica. I recettori degli estrogeni svolgono un ruolo cruciale nel cancro al seno, rendendoli bersagli terapeutici per l’inibizione della crescita tumorale.
Uno studio pubblicato questa settimana negli Atti della National Academy of Sciences spiega il legame tra la particolare struttura delle proteine alfa del recettore degli estrogeni e il modo in cui questi recettori funzionano a livello molecolare .
“Questa molecola ha due regioni o domini che normalmente non si toccano”, ha detto il fisico teorico della Rice Peter Wolynes, autore corrispondente dello studio. “Invece, sono separati da due strutture simili a stringhe. Il puzzle era, come comunicano tra loro questi due domini? Come viene trasmessa l’informazione che un ormone è legato al dominio che lega il DNA?”
Utilizzando un software chiamato AWSEM che il suo gruppo di ricerca ha sviluppato per prevedere la struttura e la dinamica delle proteine, Wolynes e il suo team di studenti laureati della Rice hanno scoperto che la regolazione degli ormoni del recettore degli estrogeni è controllata da una strategia di comunicazione molecolare precedentemente sconosciuta.
“Per la maggior parte della mia carriera, il punto di vista dominante su come funzionano le molecole proteiche è stato che sono oggetti abbastanza rigidi e che la loro meccanica molecolare implicava interazioni come quelle in macchine semplici, usando leve e cardini. Quindi, è molto strano quando hai queste strutture filanti perché non sembrano funzionare così”, ha detto Wolynes.
La precedente ricerca di Wolynes ha scoperto che le strutture proteiche simili a stringhe possono agire come le braccia di un polpo.
“Il braccio di questo polpo fibroso trova qualcosa, lo afferra e poi si organizza”, ha detto. “Questo è un meccanismo che abbiamo scoperto molto tempo fa e che abbiamo chiamato lancio al volo. È stato visto in molti sistemi”.
Nel caso della proteina del recettore degli estrogeni, il fatto che le diverse aree della molecola siano collegate da due strutture simili a stringhe ha reso difficile spiegare come la regione della molecola che si lega all’ormone, nota come dominio di legame del ligando, comunica con la regione della molecola che si attacca al DNA, o il dominio di legame al DNA.
“Facendo una simulazione della dinamica della molecola, ciò che abbiamo scoperto è che quando il dominio di legame del ligando cambiava struttura, ruotava e spostava le stringhe un po’ più distanti. In tal modo, accorciava le stringhe che lo collegavano al altro dominio, portandolo a stretto contatto con il DNA. Questo è come il modo in cui un burattinaio manipolerebbe una marionetta “, ha detto Wolynes.
“A nostra conoscenza, nessuno ha mai pensato a questa idea che le due stringhe sostanzialmente cooperassero tra loro per funzionare come una marionetta”, ha aggiunto.
Le mutazioni del recettore degli estrogeni sono collegate a numerose altre malattie e tipi di cancro oltre al cancro al seno .
“Si scopre che alcune delle mutazioni che disabilitano il recettore degli estrogeni nei tumori si verificano esattamente in questa regione cardine”, ha detto della regione composta dalle strutture simili a corde. “Questo è qualcosa che ora possiamo iniziare ad analizzare. Pensiamo che darà un’idea alle persone che lavorano sul lato farmacologico sul motivo per cui quella regione nel recettore degli estrogeni è disabilitata in alcuni casi e non in altri”.
Wolynes ha affermato che la scoperta potrebbe aiutare a rimodellare la comprensione di come le molecole dei recettori ormonali funzionano in modo più ampio.
“Pensiamo che questo possa essere un meccanismo funzionale molto comune nella dinamica delle proteine”, ha detto Wolynes. “Ci sono molti altri recettori ormonali che hanno un’organizzazione simile di domini strutturati collegati da stringhe”.
La questione della previsione della struttura delle proteine, a volte chiamata problema del ripiegamento delle proteine, ha attirato molta attenzione negli ultimi anni a causa dello sviluppo di AlphaFold , un sistema di DeepMind derivato dall’intelligenza artificiale di Google che prevede la struttura 3D delle proteine in base alla loro sequenza di amminoacidi. .
Wolynes ha affermato che mentre AlphaFold si concentra sulla previsione della forma particolare in cui si piegherà una proteina, mentre AWSEM, sviluppato e mantenuto dal suo gruppo di ricerca alla Rice e dal chimico del laboratorio dell’Università del Maryland Garegin Papoian , predice sia la forma piegata di una proteina e come si comporterà e interagirà all’interno del suo ambiente molecolare.
“Abbiamo anche fatto abbastanza bene nel famoso concorso di valutazione critica della previsione della struttura proteica , o CASP, in cui AlphaFold ha fatto così bene”, ha detto Wolynes delle capacità di AWSEM.

